- Nguyên tắc 1: Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
- Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị trong nguyên tử được sắp xếp thành một cột.
+ Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học (electron lớp ngoài cùng hoặc phân lớp kế ngoài cùng chưa bão hòa).
II. CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
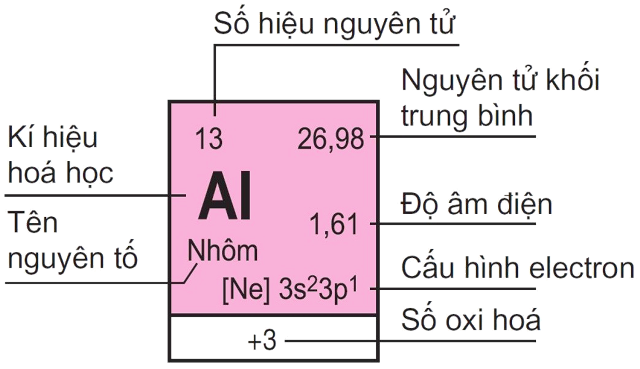
1. Ô nguyên tố
- Mỗi nguyên tố hóa học được xếp vào một ô của bảng gọi là ô nguyên tố.
- Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
2. Chu kì
a) Định nghĩa
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
b) Giới thiệu các chu kì
- Chu kì 1: gồm 2 nguyên tố $H\,(Z=1)$ đến $He\,(Z=2)$.
- Chu kì 2: gồm 8 nguyên tố $Li\,(Z=3)$ đến $Ne\,(Z=10)$.
- Chu kì 3: gồm 8 nguyên tố $Na\,(Z=11)$ đến $Ar\,(Z=18)$.
- Chu kì 4: gồm 18 nguyên tố $K\,(Z=19)$ đến $Kr\,(Z=36)$.
- Chu kì 5: gồm 18 nguyên tố $Rb\,(Z=37)$ đến $Xe\,(Z=54)$.
- Chu kì 6: gồm 32 nguyên tố $Cs\,(Z=55)$ đến $Rn\,(Z=86)$.
- Chu kì 7: Bắt đầu từ nguyên tố $Fr\,(Z=87)$ đến nguyên tố có $Z=110$, đây là một chu kì chưa hoàn thành.
c) Phân loại chu kì
- Chu kì $1,\, 2,\, 3$ là các chu kì nhỏ.
- Chu kì $4,\, 5,\, 6,\, 7$ là các chu kì lớn.
$ \Rightarrow$ Nhận xét:
- Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau và bằng số thứ tự của chu kì.
- Mở đầu chu kì là kim loại kiềm, gần cuối chu kì là halogen (trừ chu kì 1); cuối chu kì là khí hiếm.
- 2 hàng cuối bảng là 2 họ nguyên tố có cấu hình electron đặc biệt: Lantan và Actini.
+ Họ Lantan: gồm 14 nguyên tố đứng sau $La\,(Z=57)$ thuộc chu kì 6.
+ Họ Actini: gồm 14 nguyên tố sau $Ac\,(Z=89)$ thuộc chu kì 7.
3. Nhóm nguyên tố
a) Định nghĩa
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
b) Phân loại
- Bảng tuần hoàn chia thành 8 nhóm A (đánh số từ IA đến VIIIA) và 8 nhóm B (đánh số từ IB đến VIIIB). Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
- Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
* Nhóm A:
- Nhóm A gồm 8 nhóm từ IA đến VIIIA.
- Các nguyên tố nhóm A gồm nguyên tố $s$ và nguyên tố $p$:
+ Nguyên tố $s$: Nhóm IA (nhóm kim loại kiềm, trừ $H$) và nhóm IIA (kim loại kiềm thổ).
+ Nguyên tố $p$: Nhóm IIIA đến VIIIA (trừ $He$).
- STT nhóm = Số $e$ lớp ngoài cùng = Số $e$ hóa trị
+ Cấu hình electron hóa trị tổng quát của nhóm A:
$ \longrightarrow n{s^a}\,\,n{p^b}$
$ \longrightarrow ĐK: 1 \le a \le 2 ;\,\, 0 \le b \le 6$
+ Số thứ tự của nhóm $A = a + b$
$ \longrightarrow$ Nếu $a+b \le 3$ $\Rightarrow$ Kim loại
$ \longrightarrow$ Nếu $5 \le {a+b} \le 7$ $\Rightarrow$ Phi kim
$ \longrightarrow$ Nếu $a+b = 8$ $\Rightarrow$ Khí hiếm
+ Ví dụ:
$ \longrightarrow Na\,(Z=11): 1{s^2}\,\,2{s^2}\,\,2{p^6}\,\,3{s^1} \,\Rightarrow \,IA$
$ \longrightarrow O\,(Z=8): 1{s^2}\,\,2{s^2}\,\,2{p^4} \,\Rightarrow \,VIA$
* Nhóm B:
- Nhóm B gồm 8 nhóm được đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn.
- Nhóm B chỉ gồm các nguyên tố của các chu kỳ lớn.
- Nhóm B gồm các nguyên tố $d$ và nguyên tố $f$ (thuộc 2 hàng cuối bảng).
- STT nhóm = Số $e$ lớp ngoài cùng = Số $e$ hóa trị (Ngoại lệ: Số $e$ hóa trị = 9, 10 thuộc nhóm VIIIB)















